CAR-T(Chimeric Antigen Receptor T)細胞療法是目前癌症免疫治療領域備受關注的生物(wù)治療手段之一。與傳統的癌症治療方式相比,CAR-T細胞療法在血液腫瘤治療中(zhōng)存在明顯優勢,取得了巨大的進步。近年來,國(guó)内CAR-T細胞療法的相關臨床試驗如雨後春筍般快速增長(cháng)。根據clinicaltrials.gov網站的數據,2017年9月,中(zhōng)國(guó)成為(wèi)CAR-T試驗注冊數量最多(duō)的國(guó)家。截至2020年6月30日,中(zhōng)國(guó)注冊CAR-T試驗的數量已達357個。除此之外,已經在ChiCTR注冊的CAR-T試驗也多(duō)達150個。
CAR-T的起源
免疫細胞療法最早起始于細胞因子技(jì )術的發展,真正意義上免疫細胞治療起始于過繼性免疫細胞療法。自1976年Morgan等人發現在體(tǐ)外可(kě)利用(yòng)白介素2(IL-2)刺激T細胞大量增殖後,科(kē)學(xué)家就開始利用(yòng)IL-2誘導淋巴因子激活的殺傷細胞(LAK),用(yòng)于治療黑色素瘤等多(duō)種惡性腫瘤,這是早期嘗試的過繼性免疫細胞療法。過繼細胞轉移也是當時創造的第一個重要術語,用(yòng)于描述通過輸注免疫細胞或免疫分(fēn)子介導器官異體(tǐ)移植排斥或治療腫瘤的療法。關于這種療法在臨床上試驗成功大約是在1980年前後,這些試驗主要是在轉移性黑色素瘤患者中(zhōng)輸注自體(tǐ)腫瘤浸潤淋巴細胞(TILs),或在複發性白血病患者中(zhōng)輸注同種異體(tǐ)供體(tǐ)淋巴細胞。直到20世紀90年代,轉基因技(jì )術開始被廣泛用(yòng)于免疫效應細胞的基因改造,其中(zhōng)主要用(yòng)于改造T細胞、DC細胞等。這個階段出現了通過使用(yòng)T細胞受體(tǐ)(TCR)或嵌合抗原受體(tǐ)(CAR)來重定向T細胞的特異性,增強T細胞功能(néng)的臨床試驗嘗試,從此CAR-T細胞出現在免疫細胞療法的舞台上,并逐漸成為(wèi)免疫細胞治療的代表。
嵌合抗原受體(tǐ)(CAR)
CAR,嵌合抗原受體(tǐ),是經過基因工(gōng)程改造的特異性靶向受體(tǐ),實際為(wèi)一種融合蛋白。結構上,主要由細胞外的抗原識别部分(fēn)和細胞内信号傳導或輔助激活的結構域組成。與基因修飾的TCR-T細胞相比,CAR-T細胞可(kě)直接識别腫瘤細胞表面的抗原,而無需抗原呈遞細胞MHC分(fēn)子對抗原進行加工(gōng)或呈遞(圖1)。
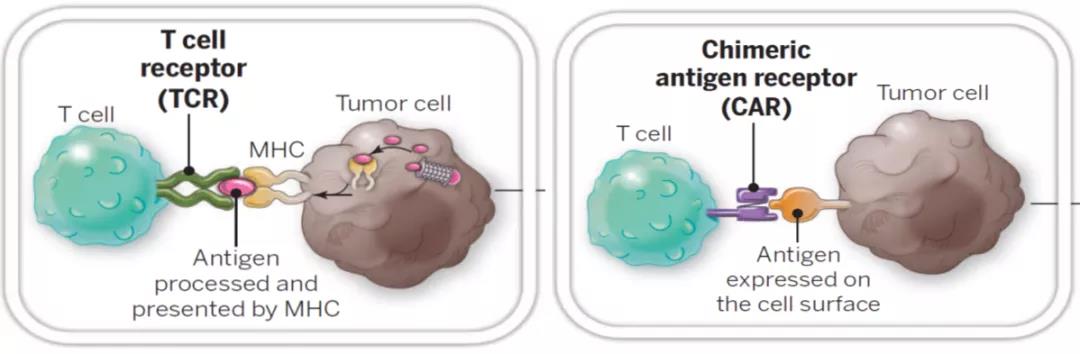
來源:Science. 2015 Apr 3;348(6230):62-8.
圖1 TCR與CAR的腫瘤抗原識别
自第一代CAR出現以來,即由抗CD19特異性單鏈可(kě)變片段、跨膜結構域和T細胞受體(tǐ)的胞内信号傳導域(CD3ζ鏈)組成的特異性靶向嵌合受體(tǐ),研究者就開始不斷對CAR進行升級叠代,提升CAR-T細胞的抗腫瘤活性。繼第一代CAR之後,第二代和第三代CAR胞内信号轉導結構域不僅包括CD3ζ結構域,同時還涵蓋了其他(tā)信号傳導域,例如CD28,CD134,CD137(4-1BB),CD27和ICOS或組合(CD3ζ,CD28和CD134),這些結構的嵌入提升了CAR T細胞的活化、增殖和存活的能(néng)力。後續第四代CAR開始采用(yòng)聯合策略,整合了表達了一些免疫分(fēn)子(如,細胞因子)顯著改善了CAR-T的抗腫瘤作(zuò)用(yòng)。如圖2所示,通過整合IL12基因的表達系統,嵌合有(yǒu)NFAT表達盒,誘導産(chǎn)生細胞因子IL12。當腫瘤抗原低表達時,CAR-T細胞無法有(yǒu)效識别腫瘤抗原,CAR的胞内CD3ζ傳導信号,誘導激活轉錄因子NFAT表達,進一步誘導産(chǎn)生和釋放細胞因子IL12,激活固有(yǒu)免疫系統,增加抗腫瘤活性。目前還出現了第五代CAR,這種CAR嵌入了IL2Rβ信号域,IL2Rβ片段可(kě)結合STAT3的YXXQ基序,誘導JAK-STAT途徑的抗原依賴性活化,促進細胞增殖,阻止終末分(fēn)化,使效應細胞表現出更好的持久性(圖2)。
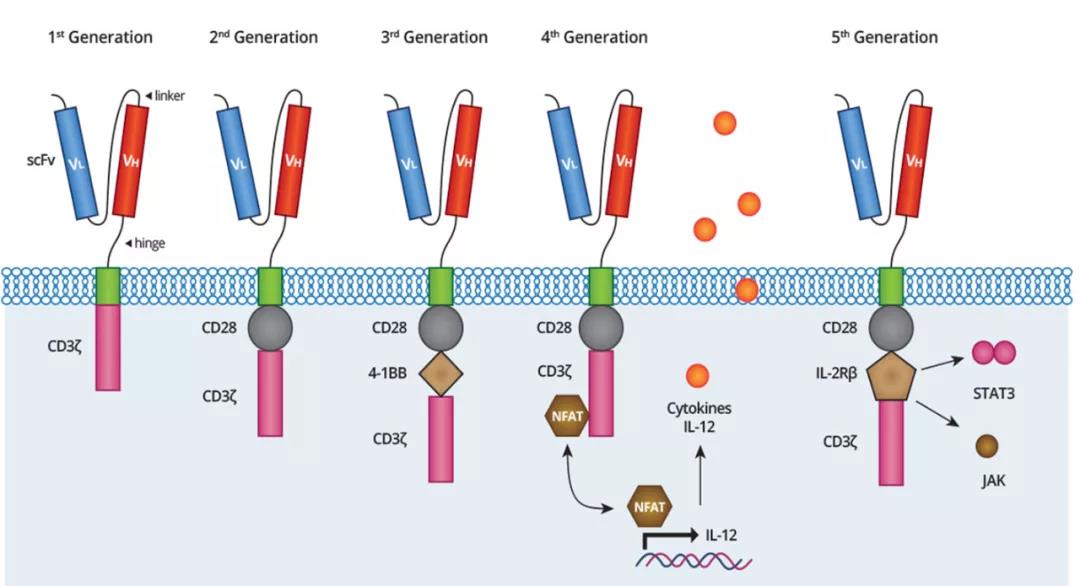
來源:Biomolecules. 2020 Feb 10;10(2):263
圖2 CAR的結構示意圖
CAR-T被輸注到患者體(tǐ)内後,通過血液循環系統并進入到靶向的腫瘤部位,對特異性的腫瘤抗原進行識别,并通過細胞毒反應或激活免疫系統殺死腫瘤細胞或增強抗腫瘤活性。一方面,CD8+ CAR-T可(kě)釋放顆粒酶和穿孔素誘導腫瘤靶細胞毒性,殺死腫瘤細胞,促進腫瘤抗原釋放,誘導CAR-T細胞增殖,進一步激活免疫系統募集内源性的細胞毒性T細胞,增強抗腫瘤活性;另一方面,CD4 + CAR-T細胞釋放細胞因子,激活免疫系統的其他(tā)成分(fēn)來增強抗腫瘤活性(圖3)。同時,免疫激活後産(chǎn)生記憶性CAR-T細胞,通過免疫監視防止腫瘤複發。
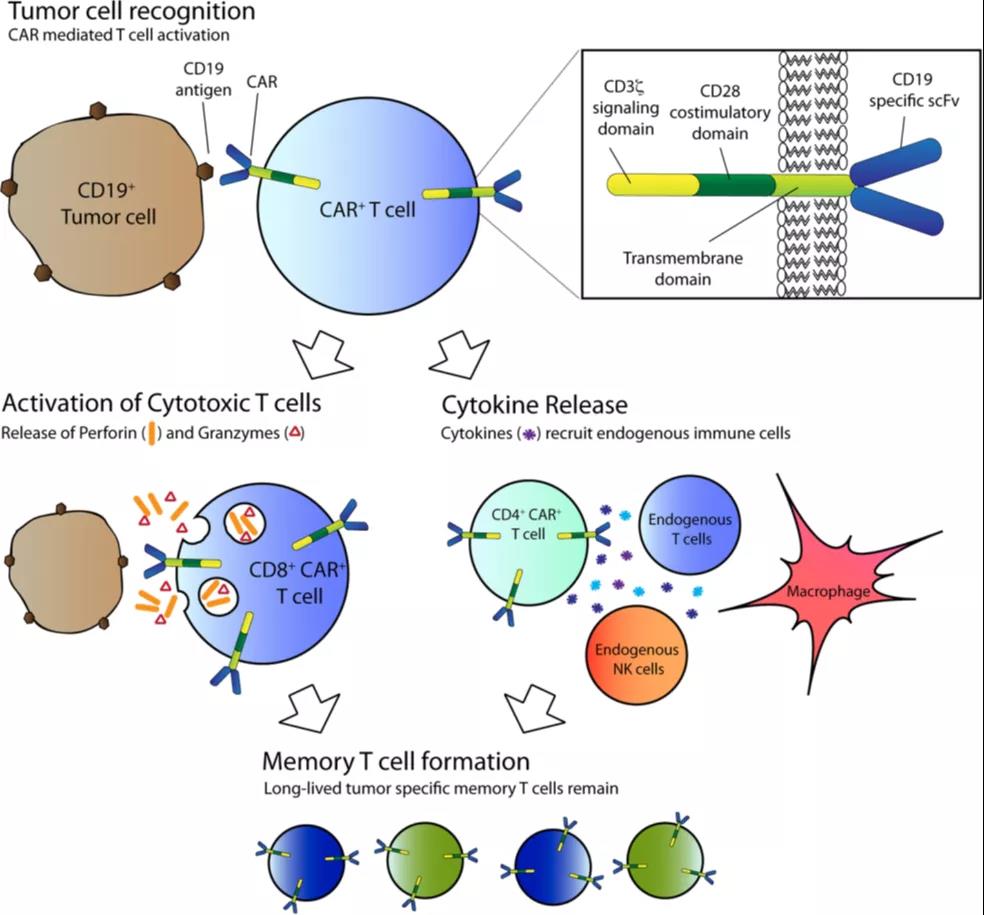
來源:Int J Hematol (2014) 99:361–371
圖3 CAR-T細胞活化和殺死靶向腫瘤細胞
CAR-T細胞治療
圖4顯示了CAR-T細胞的治療過程,主要包括:
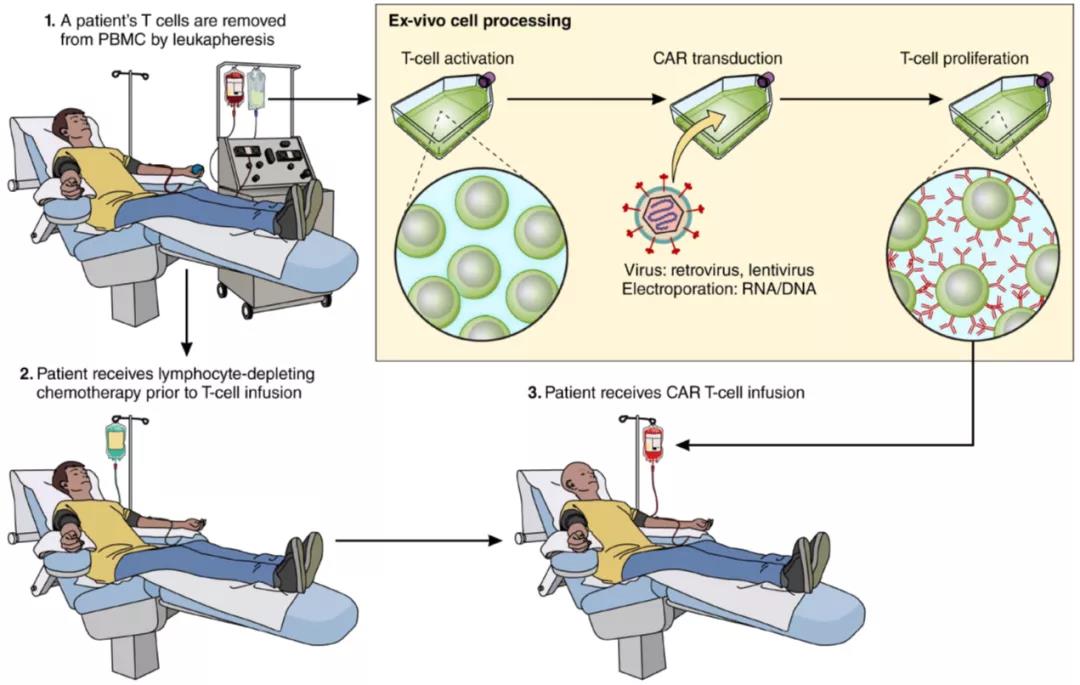
來源:Blood. 2017 Dec 14; 130(24): 2594–2602.
圖4 CAR-T細胞治療過程
目前CAR-T細胞療法還是個體(tǐ)化的治療方式,需要以患者的T細胞為(wèi)原材料進行制備。為(wèi)了避免這種個體(tǐ)化的治療現狀,研究人員也在研究通用(yòng)CAR,這種CAR可(kě)用(yòng)于許多(duō)不同的患者但又(yòu)不會引起排斥反應;除T細胞外,其他(tā)類型的免疫細胞,例如NK細胞,巨噬細胞等,研究者在進行相關的腫瘤免疫細胞治療的嘗試。
CAR-T臨床試驗進展
近幾年,國(guó)内關于CAR-T細胞療法的臨床試驗如雨後春筍般快速增長(cháng)。根據clinicaltrials.gov網站的數據,2017年9月,中(zhōng)國(guó)成為(wèi)CAR-T臨床試驗注冊數量最多(duō)的國(guó)家。截至到2020年6月30日,關于CAR-T療法的臨床試驗注冊統計顯示,中(zhōng)國(guó)境内已注冊的臨床試驗有(yǒu)357項,美國(guó)256項,其他(tā)國(guó)家/地區(qū)58項(圖5A)。除此之外,已經在ChiCTR注冊的CAR-T試驗也多(duō)達150個。
目前國(guó)内在研的CAR-T産(chǎn)品,靶向CD19的CAR-T臨床試驗很(hěn)多(duō),共有(yǒu)175項(包括台灣的2項),其中(zhōng)128項臨床試驗是單一靶向CD19的CAR-T療法,聯合靶向CD22的CAR-T臨床試驗有(yǒu)18項,聯合靶向CD20 的CAR-T臨床試驗有(yǒu)13項。靶向B細胞成熟抗原(BCMA)的臨床試驗位居第二,共有(yǒu)43項試驗,其中(zhōng)單一靶向BCMA有(yǒu)27項,另有(yǒu)聯合靶向CD19的有(yǒu)8項。除CD19和BCMA之外,還有(yǒu)一些其他(tā)的靶向分(fēn)子用(yòng)于血液系統惡性腫瘤的治療,如CD22,CD20和CD123等(圖5B)。
對于實體(tǐ)瘤的CAR-T療法,間皮素是目前主要的靶向分(fēn)子,目前共有(yǒu)注冊的臨床試驗21項。MUC1是另一個實體(tǐ)瘤熱點的靶向分(fēn)子,涉及共14項臨床試驗。除間皮素和MUC1外,還有(yǒu)其他(tā)的靶向分(fēn)子如GD2,GPC3,HER2和EGFR等用(yòng)于實體(tǐ)瘤的CAR T免疫治療(圖5C)。
根據clinicaltrials.gov網站的數據,目前在中(zhōng)國(guó)的357項CAR-T臨床試驗中(zhōng),臨床I期涉及306項,臨床 II期19項,III期研究1項(2020年注冊)。美國(guó)的256項CAR-T臨床試驗,I期,II期和III期研究的數量分(fēn)别為(wèi)209、25和4。其他(tā)國(guó)家/地區(qū)的58項CAR-T臨床試驗,I期,II期和III期研究的數量分(fēn)别為(wèi)42、7和1。目前,中(zhōng)國(guó)的大多(duō)數CAR-T臨床試驗都處于早期階段,其主要目的是驗證安(ān)全性。這可(kě)能(néng)是因為(wèi)在中(zhōng)國(guó),大多(duō)數試驗都是非商(shāng)業性自主的研究項目,并且大部分(fēn)項目缺乏被開發為(wèi)藥物(wù)的潛力(圖5A)。
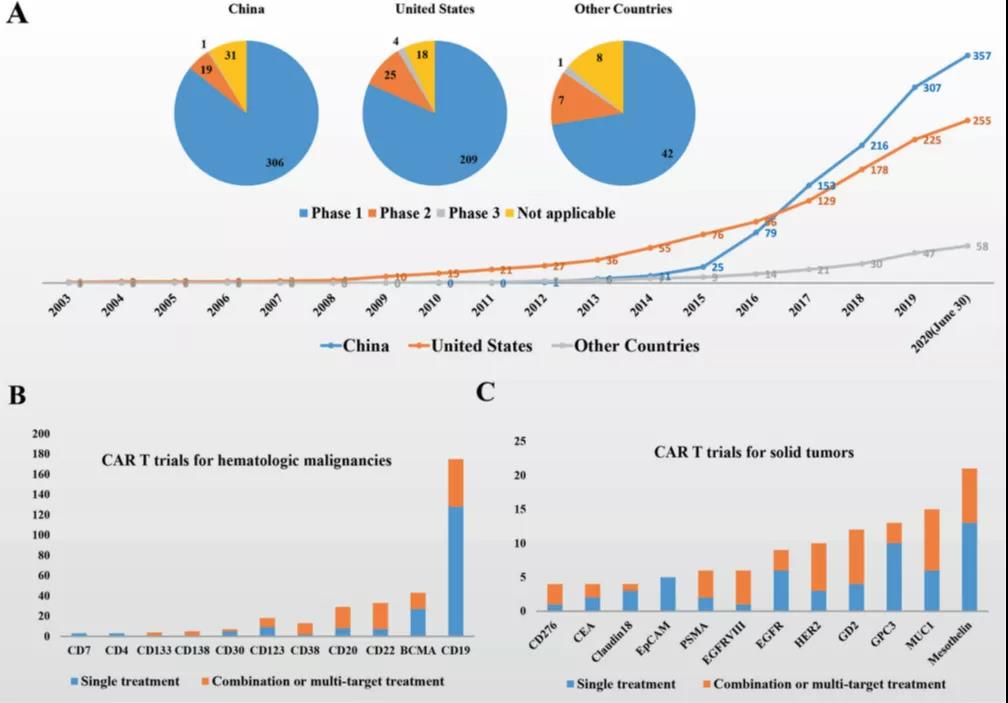
來源:Cell Mol Immunol. 2020 Sep 30
圖5 A. 已注冊的CAR-T臨床試驗數量和當前試驗階段的年度變化統;
B. 當前在中(zhōng)國(guó)注冊的血液系統惡性腫瘤CAR-T臨床試驗;C. 目前在中(zhōng)國(guó)注冊的實體(tǐ)瘤CAR-T試驗
回顧CAR-T的臨床治療成果,以抗CD19為(wèi)代表的CAR-T療法在血液系統惡性腫瘤中(zhōng)取得了令人矚目的成績。目前全球已有(yǒu)三款 CAR-T 産(chǎn)品獲批上市,分(fēn)别是諾華的 Kymriah、吉利德(dé)旗下凱特制藥的 Yescarta和Tecartus。Kymriah 被批準用(yòng)于治療複發難治 B 細胞前體(tǐ)急性淋巴性白血病 (B-ALL) 25 歲以下患者和彌漫性大 B 細胞淋巴瘤(DLBCL )成人患者;Yescarta 被批準用(yòng)于治療成人複發或難治性大 B 細胞淋巴瘤患者。Tecartus 則被批準用(yòng)于治療複發或者難治性的套細胞淋巴瘤(MCL)成人患者(表1)。
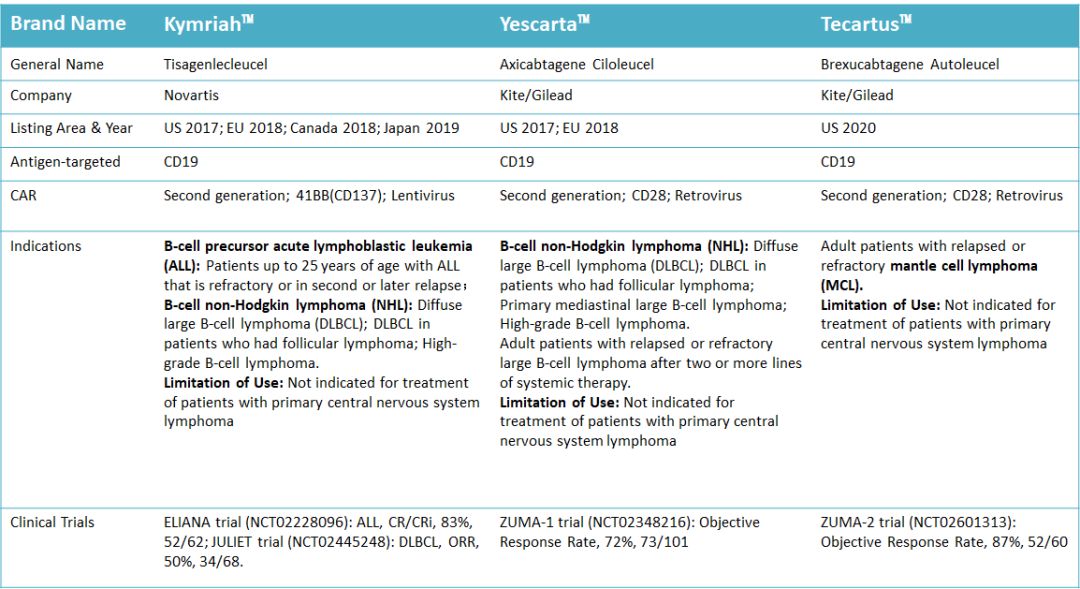
表1 全球上市的三款 CAR-T 産(chǎn)品介紹
數據來源:https://dailymed.nlm.nih.gov/dailymed
目前,國(guó)内還未有(yǒu)批準上市的CAR-T産(chǎn)品,但是其中(zhōng)已有(yǒu)兩家公(gōng)司在2020年提交CAR-T産(chǎn)品的上市申請。分(fēn)别是複星凱特的CAR-T療法 FKC876(暫定:益基利侖賽注射液,國(guó)外商(shāng)品名(míng):Yescarta )的上市申請和藥明巨諾的 CAR-T療法 JWCAR029(暫定:瑞基侖賽注射液)是在美國(guó) Juno 公(gōng)司 JCAR017 基礎上,由藥明巨諾自主開發的靶向 CD19 的 CAR-T 療法。此外,傳奇生物(wù) CAR-T 療法 LCAR-B38M 預計于 2021 年提交上市申請。
參考文(wén)獻:
1. Wei J, Guo Y, et al. Clinical development of CAR T cell therapy in China: 2020 update. Cell Mol Immunol. 2020 Sep 30. doi: 10.1038/s41423-020-00555-x.
2. Varadé J, Magadán S, González-Fernández Á. Human immunology and immunotherapy: main achievements and challenges. Cell Mol Immunol. 2020 Sep 2:1–24. doi: 10.1038/s41423-020-00530-6.
3. Rosenberg SA, Restifo NP. Adoptive cell transfer as personalized immunotherapy for human cancer. Science. 2015 Apr 3;348(6230):62-8. doi: 10.1126/science.aaa4967.
4. Wu C, Zhang L, Brockman QR, Zhan F, Chen L. Chimeric antigen receptor T cell therapies for multiple myeloma. J Hematol Oncol. 2019 Nov 21;12(1):120. doi: 10.1186/s13045-019-0823-5.
5. Brudno JN, Kochenderfer JN. Chimeric antigen receptor T-cell therapies for lymphoma. Nat Rev Clin Oncol. 2018 Jan;15(1):31-46. doi: 10.1038/nrclinonc.2017.128.
6. Subklewe M, von Bergwelt-Baildon M, Humpe A. Chimeric Antigen Receptor T Cells: A Race to Revolutionize Cancer Therapy. Transfus Med Hemother. 2019 Feb;46(1):15-24. doi: 10.1159/000496870.
7. June CH, Sadelain M. Chimeric Antigen Receptor Therapy. N Engl J Med. 2018 Jul 5;379(1):64-73. doi: 10.1056/NEJMra1706169.
8. Davila ML, Bouhassira DC, et al. Chimeric antigen receptors for the adoptive T cell therapy of hematologic malignancies. Int J Hematol. 2014 Apr;99(4):361-71. doi: 10.1007/s12185-013-1479-5.
9. Kalaitsidou M, Kueberuwa G, et al. CAR T-cell therapy: toxicity and the relevance of preclinical models. Immunotherapy. 2015;7(5):487-97. doi: 10.2217/imt.14.123.
10. Morello A, Sadelain M, et al. Mesothelin-Targeted CARs: Driving T Cells to Solid Tumors. Cancer Discov. 2016 Feb;6(2):133-46. doi: 10.1158/2159-8290.CD-15-0583.
11. Kim DW, Cho JY. Recent Advances in Allogeneic CAR T Cells. Biomolecules. 2020 Feb 10;10(2):263. doi: 10.3390/biom10020263.
12. https://dailymed.nlm.nih.gov/dailymed; NDC Code(s): 71287-219-01, 71287-219-02; NDC Code(s): 71287-119-01, 71287-119-02; NDC Code(s): 0078-0846-19, 0078-0958-19.